S XIX > 1808 > John Dalton > Retoma el concepto "ÁTOMO" > Modelo Dalton

¿Qué consiguió explicar?
El modelo permitió aclarar por primera vez el porqué las sustancias químicas reaccionaban en proporciones estequiométricas fijas y por qué cuando dos sustancias reaccionan para formar dos o más compuestos diferentes, entonces las proporciones de estas relaciones son números enteros.Además el modelo aclaraba que aún existiendo una gran variedad de sustancias diferentes, estas podían ser explicadas en términos de una cantidad más bien pequeña de constituyentes elementales o elementos.
"En esencia, el modelo explicaba la mayor parte de la química orgánica del siglo XIX, reduciendo una serie de hechos complejos a una teoría combinatoria realmente simple."
¿Qué no consiguió explicar?
La hipótesis de John Dalton, que afirmaba que los elementos en estado gaseoso eran monoatómicos y que los átomos de los elementos se combinaban en la menor proporción posible para formar átomos de los compuestos, lo que hoy llamamos moléculas, generó algunas dificultades.
-Modelo Thomson
S XIX > 1897 > Thomson > Descubrió el "ELECTRÓN" > Modelo Thomson

¿Qué consiguió explicar?
Era capaz de explicar fenómenos eléctricos como los rayos catódicos y fenómenos nuevos como la radioactividad.
¿Qué no consiguió explicar?
Si bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la química y los rayos catódicos, hacía predicciones incorrectas sobre la distribución de la carga positiva dentro de los átomos.
Tampoco consiguió explicar la regularidad de la tabla periódica de Mendeleiev.
-Modelo Rutherford
S XX > 1911 > Rutherford > Experimento Rutherford > Modelo Rutherford

¿Qué consiguió explicar?
El modelo atómico de Rutherford, permitió explicar que la carga positiva estaba concentrada en una pequeña región en el centro del átomo, que es lo que más tarde se conoció como núcleo atómico;revelando la existencia de un núcleo atómico cargado positivamente y de elevada densidad.
Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el núcleo mismo, y en consecuencia, que el interior de un átomo está prácticamente vacío.
Si bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la química y los rayos catódicos, hacía predicciones incorrectas sobre la distribución de la carga positiva dentro de los átomos.
Tampoco consiguió explicar la regularidad de la tabla periódica de Mendeleiev.
-Modelo Rutherford
S XX > 1911 > Rutherford > Experimento Rutherford > Modelo Rutherford

¿Qué consiguió explicar?
El modelo atómico de Rutherford, permitió explicar que la carga positiva estaba concentrada en una pequeña región en el centro del átomo, que es lo que más tarde se conoció como núcleo atómico;revelando la existencia de un núcleo atómico cargado positivamente y de elevada densidad.
Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el núcleo mismo, y en consecuencia, que el interior de un átomo está prácticamente vacío.
¿Qué no consiguió explicar?
No pudo explicar cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño.
Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electromagnética, perdiendo energía y finalmente cayendo sobre el núcleo.
Toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.
Se trata de un modelo físicamente inestable, desde el punto de vista de la física clásica.
-Modelo Bohr
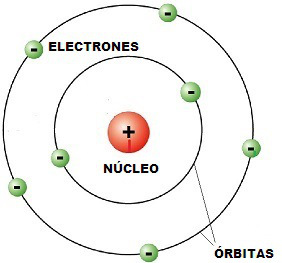
¿Qué consiguió explicar?
Explicaba cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos.
¿Qué no consiguió explicar?
No pudo explicar los espectros de átomos más complejos. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser desechada. Las nuevas ideas sobre el átomo están basadas en la mecánica cuántica, que el propio Bohr contribuyó a desarrollar.
Los electrones de un mismo nivel energético tenían energías ligeramente diferentes.
-Modelo atómico actual
¿Qué consiguió explicar?
En este modelo los electrones se contemplaban originalmente como una onda estacionaria de materia cuya amplitud decaía rápidamente al sobrepasar el radio atómico.
Los electrones de un mismo nivel energético tenían energías ligeramente diferentes.
En este modelo los electrones se contemplaban originalmente como una onda estacionaria de materia cuya amplitud decaía rápidamente al sobrepasar el radio atómico.
Los electrones de un mismo nivel energético tenían energías ligeramente diferentes.